【特康特食】4月20日世界高尿酸血症日 "關愛高尿酸人群營養與健康"
發表時間:2023-04-20

一、高尿酸血症和痛風的流行病學
痛風是同遺傳有關的嘌呤代謝紊亂或與尿酸排洩減少有關所引起的一組代謝性疾病。其臨床特點為反複發作的急性關
節炎、高尿酸血症、尿路結石、腎尿酸結石,嚴重者導緻關節強直或畸形、腎實質損害等。痛風發病的關鍵生化基礎是高
尿酸血症(HUA)。研究表明,約有5%~19%的HUA會發展為痛風[1]。
1.高尿酸血症和痛風發病率
痛風在亞洲被視為一種罕見疾病,而在歐美地區則是一種常見疾病,随着人們飲食結構的變化,高蛋白、高嘌呤食物
攝入量日益增多,高尿酸血症和痛風在我國也逐漸成為常見疾病。 2013年我國HUA患病率男性約為16.85%~18.32%,
女性約為7.88%~9.30%,痛風患病率男性約為0.83%~1.98%,女性約為0.07%~0.72%,較以前明顯上升[2]。
據中國疾病控制中心報告,全國高尿酸血症患者超過8000萬,比15年前增加了15~30倍,預計2020年中國痛風患者将跨越1億[3]。
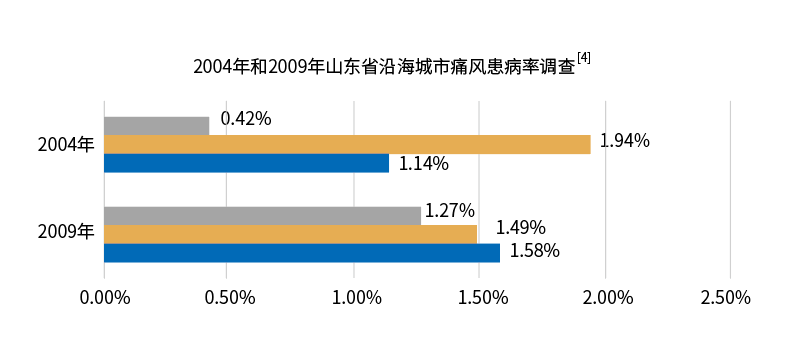
2.高尿酸血症和痛風的分布特點
(1)年齡差異
高尿酸血症、痛風與年齡因素具有重大的關聯。中老年人為原發性痛風的高發群體,44歲為平均發病年齡[5]。但近幾年來,
發病年齡趨于年輕化,2014年的調查結果顯示20~30歲的年輕人占據此病症群體的64%。
(2)性别差異
男性痛風發病率顯著高于女性,其原因主要為男性體内的雄激素可促進腎髒重吸收尿酸而抑制尿酸排洩,而女性體内的17β
-雌二醇可以調節尿酸代謝及嘌呤生物合成過程,從而降低尿酸水平[6]。
(3)地區差異
2015年《國際内分泌代謝雜志》指出82%的人群因地理位置患有此種病症,我國大多數流行病學研究也發現,沿海地區
痛風與高尿素血症的發病率高于内陸地區,主要原因為當地居民海産品攝入量明顯高于内地[7]。
3.病因及發病機制
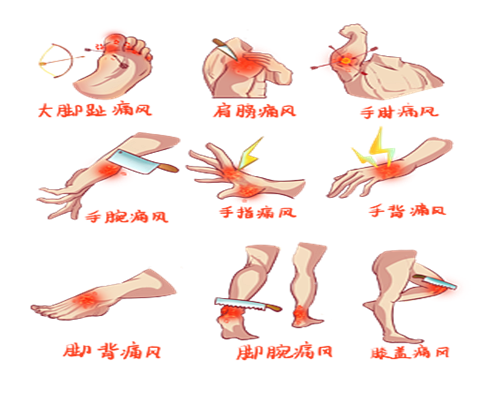
痛風的直接原因是高尿酸血症。當高尿酸血症患者出現尿酸鹽結晶沉積、關節炎和(或)腎病、腎結石等時,才稱為痛風[8]。痛風可分為原發性痛風和繼發性痛風兩大類。
(1)原發性痛風
原發性痛風大多為先天遺傳性。遺傳特點為X連鎖隐性遺傳,女性為攜帶者,男性發病[6]。其原因是多方面的,以下面兩個方面為主:
① 尿酸清除減少
這類患者約占痛風的90%,臨床檢查可發現其尿酸的清除能力明顯低于正常人,70%~80%的患者顯示腎髒功能不全,總體表現為痛風患者存在腎髒的尿酸代謝功能紊亂。
② 尿酸産生過多
由先天性嘌呤代謝障礙引起的,主要是尿酸酶基因失活以及尿酸合成過程中關鍵酶的基因缺陷,如次黃嘌呤-鳥嘌呤磷酸核糖轉移酶缺乏、磷酸核糖焦磷合成酶活性增高。
(2)繼發性痛風[9]
繼發于其他疾病,包括遺傳性疾病、獲得性疾病或藥物,主要由于腎髒疾病導緻尿酸排洩減少,骨髓增生性疾病及放療至尿酸生成增多,某些藥物抑制尿酸的排洩等多種原因所緻。
二、高尿酸血症和痛風的臨床症狀
1.無症狀期
此期僅有尿酸的持續性或波動性增高,但無關節炎、痛風石、腎結石等臨床表現,有些可終生不出現症狀。
2.急性期
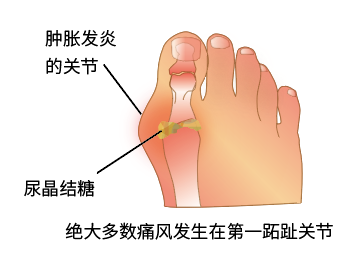
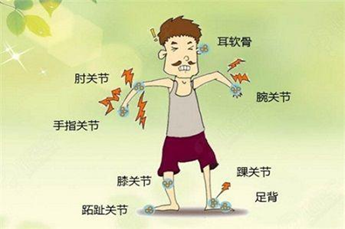
以急性關節炎為主要臨床表現,典型症狀的特點是驟然起病,最常侵犯的部位是第一跖趾,
數小時内出現受累關節的紅、腫、熱、痛和功能障礙,病程持續時間可在數小時或數日不等。
3. 間歇期
兩次發作之間的一段靜止期。大多數患者一生會發作多次,間隔時間可為6個月至1年,甚至5~10年不等。未進行治療發作次數會越來越頻繁。
4. 慢性期
主要臨床表現為痛風石、慢性關節炎、尿路結石和腎炎等。
5. 高尿酸血症和痛風的臨床診斷
高尿酸血症和痛風的檢查手段主要有血尿酸測定、尿尿酸測定、關節液或痛風石内容物檢查、X線檢查、電子計算機X線體層顯像(CT)與磁共振顯像(MRI)檢查以及超聲檢查。
男性和絕經後女性血尿酸>420μmol/L(7.0mg/dl)、絕經前女性>358μmol/L(6.0mg/dl)可診斷為高尿酸血症。
如出現特征性關節炎表現、尿路結石或腎絞痛發作,伴有高尿酸血症應考慮痛風,關節液穿刺或痛風石活檢發現尿酸鹽結晶可确診痛風[12]。
三、高尿酸血症和痛風的治療方法
痛風治療目标是控制急性關節炎發作及複發、預防尿酸鹽沉積、促進痛風石吸收、防止慢性關節炎進展、防止尿酸性腎結石、痛風性腎病及腎功能損害。患者教育、适當的生活方式和飲食習慣是痛風長期治療的基礎。

1. 飲食治療
(1)限制嘌呤:病人應長期控制嘌呤攝入,選用低嘌呤食物,禁用高嘌呤食物。
(2)限制熱能:一般為1500~1800kcal,切忌減重過快,應循序漸進。
(3)蛋白質:應以植物蛋白為主,動物蛋白可選用牛奶、雞蛋。
(4)供給充足B族維生素和維生素C。
(5)禁用強烈香料及調味品,如酒和辛辣調味品。
(6)每日飲水應在2000ml以上,最好能達到3000ml,慎用抑制尿酸排洩的藥物[13]。
2. 急性痛風關節炎治療
秋水仙堿、非甾體抗炎藥(NSAIDs)和糖皮質激素是急性痛風性關節炎治療的一線藥物。
急性發作期不進行降尿酸治療,但已服用降尿酸藥物者不需停用,以免引起尿酸波動,導緻發作時間延長或再次發作。
3. 間歇期和慢性痛風關節炎治療
采用降尿酸藥物治療,目标是血尿酸濃度低于6mg/dl,以減少或清除體内沉積的尿酸鹽結晶。降尿酸藥物應在急性發作緩解後從小劑量開始,逐漸加量,并根據血尿酸調整至最小有效劑量長期甚至終身維持。
(1)抑制尿酸合成藥物:别嘌醇、非布司他
(2)促進尿酸排洩藥物:丙磺舒、苯溴馬隆
(3)尿酸酶
在開始降尿酸治療時,推薦同時服用秋水仙堿0.5~1mg/d或小劑量NSAIDs1~12個月,以預防急性痛風發作。
4. 痛風腎髒病變治療
應選用抑制尿酸合成藥物,同時堿化尿液,保持尿量。其他處理同慢性腎炎,如出現腎功能不全,可行透析治療,必要時可做腎移植。
5. 伴發疾病治療
痛風常伴發代謝綜合征,如高血壓、高脂血症、肥胖症、2型糖尿病等,應積極治療上述伴發疾病。
6. 無症狀高尿酸血症治療
以飲食治療為主,一般不推薦使用降尿酸藥物。如經飲食控制血尿酸仍高于9mg/dl或血尿酸高于8mg/dl并有家族史或伴發相關疾病的患者,可考慮降尿酸治療
7. 手術治療
必要時可選擇剔除痛風石、對殘毀關節進行矯形等手術治療[14]。
四、高尿酸血症和痛風患者的營養代謝和營養需求
1.營養代謝特點
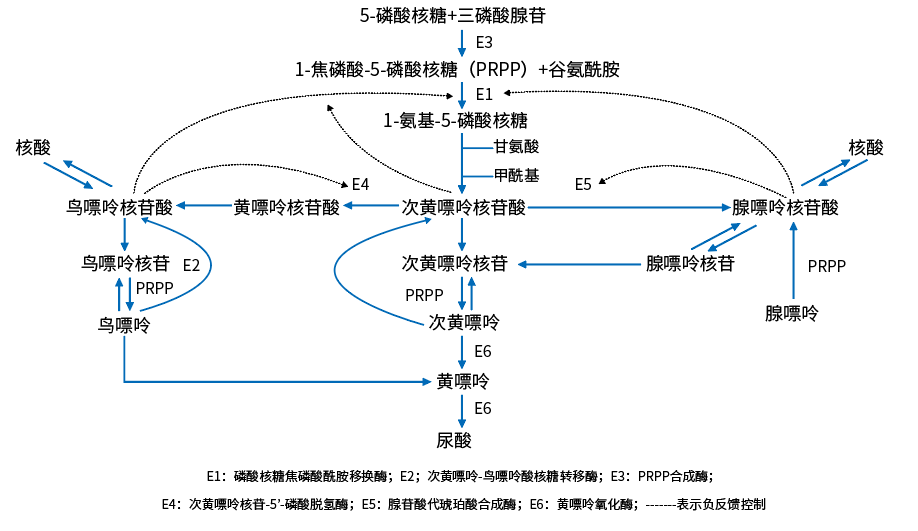
嘌呤代謝的終産物主要由細胞代謝分解的核酸和其他嘌呤類化合物,以及食物中的嘌呤經酶的作用分解而來。人體中尿酸80%來源于内源性嘌呤代謝,20%來源于富含嘌呤或核酸蛋白食物。
實際上食物來源的嘌呤和嘧啶很少被機體利用。但痛風患者由于存在嘌呤代謝有關酶的異常,可利用外源性嘌呤通過合成補救途徑使嘌呤核苷酸合成增加,然後再體内分解産生尿酸。
高蛋白、高嘌呤的攝入也可通過腺苷三磷酸(ATP)分解加速。ATP分解可形成腺苷二磷酸、腺苷一磷酸、一磷酸次黃嘌呤核苷酸、一磷酸黃嘌呤核苷酸等,最後在黃嘌呤氧化酶作用下生成尿酸。
有研究表明,大量飲酒可使參與機體氧化還原反應的重要輔酶煙酰胺腺嘌呤二核苷酸(NADH)大量消耗,使ATP生成障礙,而加速其分解,使血尿酸升高引發痛風。
B族維生素和維生素C可促進組織沉積的尿酸鹽溶解,有利于緩解痛風[15]。
2. 營養需求:
痛風患者不能采用正常人膳食,需要避免進食動物内髒、含糖飲料和酒,限制肉、海鮮和甜點的攝入。
痛風多為肥胖患者,且大多數痛風患者具有長期飲食和作息不規律,吸煙,酗酒等不良生活習慣,易造成飲食不均衡,進一步形成營養不良。
痛風患者飲食中應注意限制高嘌呤食物的攝入,但如果盲目忌口,同樣會造成營養失衡,不利于防止和延緩急性痛風的發作。
因此,對痛風患者采用合理、均衡、科學的長期膳食幹預在痛風整個病程中極其重要。
五、高尿酸血症和痛風患者的營養幹預
高尿酸血症和痛風患者營養支持、治療專家共治&指南
1、痛風及高尿酸血症基層診療指南(2019年)(中華醫學會 中華醫學會全科醫學分會)
2、中國高尿酸血症與痛風診療指南(2019)(中華醫學會内分泌學分會)
3、2016中國痛風診療指南(中華醫學會風濕病學分會)
4、高尿酸血症和痛風治療的中國專家共識(中華醫學會内分泌學分會)
5、中國慢性腎髒病患者合并高尿酸血症診治專家共識(中國慢性腎髒病患者合并高尿酸血症診治共識專家組)
6、中國高尿酸血症相關疾病診療多學科專家共識(高尿酸血症相關疾病診療多學科共識專家組)
《2016中國痛風診療指南》指出,痛風患者應遵循下述原則:
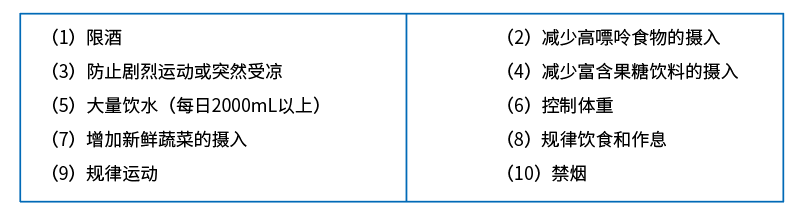
參考以上指南與專家共識,醫學營養治療推薦意見主要如下: 能量給予按标準體重計算,25~30kcal/(kg·d); 蛋白質0.8~1g/(kg·d),50~70g/d; 痛風急性發作時以植物蛋白為主,以免體内尿酸形成增加; 脂肪占總能量的20~25%,為40~50g/d; 碳水化合物占總能量的55~66%; 應注意供給B族維生素和維生素C; 痛風急性發作時,嚴格限制嘌呤攝入,并計算每日實際攝入嘌呤量,控制在小于150mg/d; 供給充足水分,液體量2000~3000ml/d,使每日尿量保持在2000ml以上,促使尿酸排出體外。
參考文獻
[1] 中國醫師協會中西醫結合醫師分會内分泌與代謝病學專業委員會,高尿酸血症和痛風病證結合診療指南( 2021-01-20),世界中醫藥,2021,16(2):183-188
[2] 李丹, 張劍勇. 痛風現代流行病學及降尿酸藥物研究進展[J]. 風濕病與關節炎, 2016, 5(04):73-76.
[3] 康藝, 蔣力生. 飲食養生對痛風病的防治意義[J]. 江西中醫藥大學學報, 2019,31(3):14-16.
[4] 楊麗華,劉曉麗,蔣雅瓊, 等.我國痛風的患病率及危險因素[J].醫學研究雜志,2019,48(12):4-6,10.
[5] 韋慧豔,唐振柱,熊潤松,等.高尿酸血症發生痛風的相關危險因素研究[J].應用預防醫學,2018,11(12):110~111.
[6] Tsai EC, Boyko EJ, Leonetti DL, et al .Low sernnl testosterone level as a predictor of increased visceral fat in Japanese-American men[ J].Int J Obes Relat Metab Disord,2000,24(4):485-491.
[7] 朱君, 餘俊文. 高尿酸血症和痛風的流行病學及其危險因素的研究進展[J]. 現代生物醫學進展, 2008(01):201-205.
[8] 孫秀發, 淩文華. 臨床營養學[M].北京:科學出版社, 2018:221-222.
[9] 齊玉梅, 郭長江, 田洪斌, 等. 現代營養治療[M].北京:中國醫藥科技出版社, 2016:336.
[10] 孫秀發, 淩文華. 臨床營養學[M].北京:科學出版社, 2018:222-223.
[11]Evans PL,Prior JA,Belcher J.et al. Obesity,hypertension and diuretic use as risk factors for incident gout: a systematic review and meta-analysis of cohort studies[J].Arthritis research &therapy,2018,20 ( 1) : 136.
[12] 王辰, 王建安, 黃從新, 等. 内科學(下冊)[M].北京:人民衛生出版社, 2016:1229.
[13] 關大順, 許先金, 關子安, 等. 現代代謝病與營養性疾病[M].天津:天津科技翻譯出版公司, 2008:495-496.
[14] 王辰, 王建安, 黃從新, 等. 内科學(下冊)[M].北京:人民衛生出版社, 2016:1230-1231.
[15] 齊玉梅, 郭長江, 田洪斌, 等. 現代營養治療[M].北京:中國醫藥科技出版社, 2016:337.

- 【特康特食】肥胖症的流行病學、臨床治療及醫學營養管理2021-08-04
- 【特康特食】阿爾茲海默症(AD)的流行學、臨床治療及醫學營養管理2021-08-02
- 【特康特食】 癫痫的流行病學、臨床治療及醫學營養管理2021-07-30
- 【特康特食】骨質疏松症的流行病學、臨床治療及醫學營養管理2021-07-28
-
-
γ-氨基丁酸複合營養粉(盒裝)
-
燕麥β-葡聚糖複合營養粉(盒裝)






 魯公網安備 37110502371133号
魯公網安備 37110502371133号